In Kürze
1965 entdeckten Wissenschaftler in Krebszellen kleine DNA-Stücke, die um die Chromosomen herum schwammen. Sie wussten nicht, was sie damit anfangen sollten, und jahrzehntelang wurden sie weitgehend ignoriert. Die Arbeiten der letzten 10 Jahre lassen jedoch vermuten, dass diese kreisförmigen DNA-Stückchen nicht einfach nur zelluläre Abfälle sind. Krebszellen nutzen die Kreise, um Gene, die mit dem Tumorwachstum und der Medikamentenresistenz zusammenhängen, schnell aufzunehmen oder abzulegen. Diese Kreise, die jetzt als extrachromosomale DNA (ecDNA) bekannt sind, könnten erklären, warum einige Tumore, wie das Glioblastom, so schwer zu behandeln sind, und es gibt bereits ein Biotech-Unternehmen, das glaubt, dass ecDNA das nächste große Ding in der Entdeckung von Krebsmedikamenten sein wird.
Für das ungeschulte Auge sehen die winzigen Flecken in der Tumorzelle nicht nach viel aus. Tatsächlich hatten andere Wissenschaftler sie schon früher bei Krebs bemerkt, sie aber im Allgemeinen als bloße Kuriosität abgetan. Doch für Paul Mischel boten die unscharfen Punkte, die er unter dem Mikroskop sah, eine verlockende Erklärung dafür, warum manche Krebsarten so schwer zu behandeln sind.
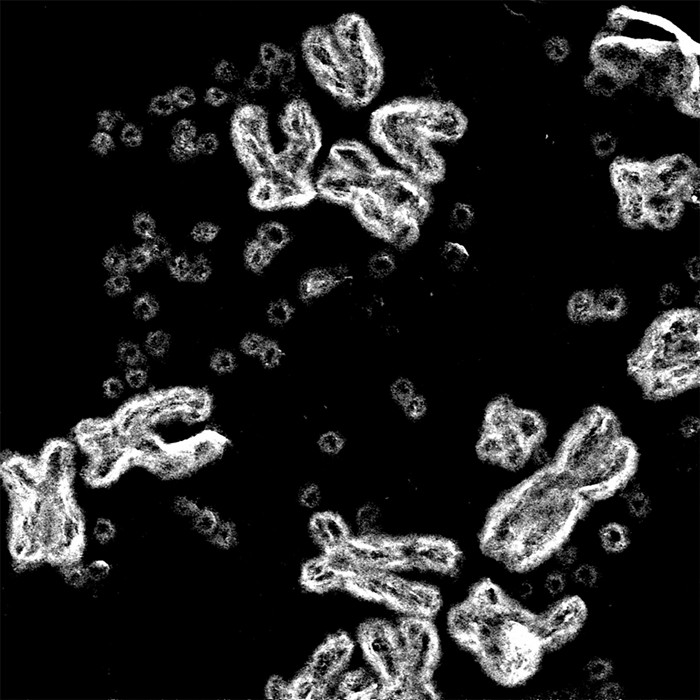
Mischel bemerkte die Flecken erstmals vor fast einem Jahrzehnt, als er Tumore untersuchte, die Genamplifikationen aufwiesen, eine Mutation, die durch mehrere Kopien eines Gens gekennzeichnet ist, das mit dem Krebswachstum in Verbindung steht. Diese zusätzlichen Kopien führen dazu, dass die Zellen Proteine produzieren, die den Tumor dazu anregen, weiter zu wachsen. Wissenschaftler waren davon ausgegangen, dass die Kopien Rücken an Rücken zwischen den anderen Genen auf unseren X-förmigen Chromosomen gestapelt waren, so als ob dieselbe Seite in der Mitte eines Buches versehentlich übereinander gedruckt worden wäre. Mischel färbte die Genvervielfältigungen rot und die Chromosomen der Krebszelle blau. Wäre es nach der gängigen Meinung gegangen, hätte sein Mikroskop einen roten Fleck auf einem der blauen Chromosomen gezeigt. Stattdessen sah der Arzt und Wissenschaftler Dutzende kleiner roter Punkte, die außerhalb der Chromosomen verstreut waren. Es war, als hätte jemand eine Seite aus dem Buch fotokopiert und dann die Kopien in die Luft geschleudert.
Menschliche Zellen sollten eigentlich keine zusätzlichen DNS-Stücke haben, also bezeichnete Mischel die merkwürdige Substanz als extrachromosomale DNS oder ecDNS. Er ahnte, dass es sich nicht einfach um genetischen Abfall handelte, und verbrachte den größten Teil des nächsten Jahrzehnts damit, herauszufinden, was diese ecDNA bei Krebs zu suchen hatte.
Die Antwort erwies sich als noch merkwürdiger, als er es sich zunächst vorgestellt hatte. Mischel, der jetzt am Ludwig Institute for Cancer Research und an der University of California San Diego arbeitet, hat seitdem nachgewiesen, dass ecDNA krebsfördernde Gene trägt und dass ihre kreisförmige Form aggressive Wachstumsstreifen und Medikamentenresistenz begünstigt. Erst letztes Jahr veröffentlichte er ein Foto, das diese Kreise deutlich neben X-förmigen Chromosomen in einer Krebszelle zeigt.
Heute steht Mischel im Mittelpunkt eines kleinen Fachgebiets, das sich der Erforschung der Kreise widmet; es wird von Wissenschaftlern bevölkert, die wie Mischel bei ihren eigenen Forschungen über die Merkwürdigkeit gestolpert sind. Jetzt, da Krebsforscher nach DNA-Kreisen suchen, sehen sie sie überall. „Diese Dinge haben sich im Verborgenen versteckt“, sagt Mischel. In einer im August veröffentlichten Studie mit 3.200 Personen haben er und seine Kollegen nachgewiesen, dass ecDNA in mindestens 15 % der Tumore vorkommt und bei bestimmten Krebsarten wie Brust-, Gebärmutterhals- und Speiseröhrenkrebs sowie bei einem tödlichen Hirntumor, dem Glioblastom, wesentlich häufiger ist.
„Diese Dinger haben sich im Verborgenen gehalten.“
Paul Mischel, Arzt und Wissenschaftler, Ludwig Institute for Cancer Research und University of California San Diego
Noch wichtiger ist, dass Menschen mit ecDNA in ihren Tumoren eine der niedrigsten 5-Jahres-Überlebensraten haben, sagt Mischel. „Das sind die Patienten, die selbst auf die innovativsten Therapien nicht gut ansprechen.
Er und andere haben sich daran gemacht, die vielen grundlegenden Fragen über ecDNA zu beantworten: Woher kommt sie? Wie fördert sie die Arzneimittelresistenz in Tumoren? Welche neuen Instrumente brauchen wir, um sie zu untersuchen? Und, was für Krebspatienten besonders wichtig ist: Kann man sie mit einem Medikament loswerden?
DNA-Kreise haben Mischels Denken über Krebs verändert, und er hofft, dass sie bald auch die Art und Weise verändern werden, wie Ärzte über die Behandlung von Krebs denken. Im Jahr 2018 half er bei der Gründung des Unternehmens Boundless Bio, um Medikamente zu entwickeln, die auf ecDNA-abhängige Tumore abzielen. Das Interesse von Biotech-Investoren an diesem aufstrebenden Bereich lässt vermuten, dass weitere Start-ups folgen werden.
„Die Bedeutung des Feldes wird davon abhängen, wie es zu neuen Erkenntnissen für Therapien führt“, sagt David Pellman, ein pädiatrischer Onkologe und Zellbiologe am Dana-Farber Cancer Institute. Im Moment ist die ecDNA nur eine elegante Erklärung dafür, warum manche Tumore so geschickt einer Behandlung widerstehen. „Es ist also wichtig, darüber Bescheid zu wissen, aber es wäre noch wichtiger, wenn wir etwas dagegen tun könnten.
Mit ecDNA schließt sich der Kreis
Im Jahr 1965 entdeckten britische Onkologen winzige DNA-Punkte, die die Chromosomen von Tumorzellen umgaben. Sie gaben den seltsamen Strukturen einen seltsamen Namen: Doppelminuten – doppelt, weil die Punkte paarweise vorkamen, und winzig, weil sie winzig waren. Heute glauben die Wissenschaftler, dass es sich bei den Doppelminuten wahrscheinlich nur um DNA-Kreise handelt, die bei der Replikation gefangen sind.
In den 1980er und 1990er Jahren fanden Wissenschaftler heraus, dass einige dieser Strukturen Genvergrößerungen enthielten und dass die Kreise mit der Arzneimittelresistenz von Tumoren in Verbindung standen. 1997 war Geoffrey Wahl, ein Krebsbiologe am Salk Institute for Biological Studies, Mitbegründer eines Unternehmens namens NewBiotics, das nach Medikamenten suchte, die die Doppelminuten aus den Zellen entfernen konnten. Die Idee wurde nie verwirklicht. „Das Humangenomprojekt in den neunziger Jahren hat viel Sauerstoff aus dem Raum gesaugt“, sagt Wahl.
Das Aufkommen der Gensequenzierung bedeutete für die Wissenschaftler, dass sie sich weniger mit merkwürdigen Beobachtungen unter dem Mikroskop beschäftigten, als vielmehr mit ihrer neu gewonnenen Fähigkeit, den genetischen Code von Krebs auf Mutationen zu untersuchen. Doch manchmal warf dieser Code Fragen auf, die die Wissenschaftler nicht beantworten konnten. Zum Beispiel, warum eine Klasse von Medikamenten namens EGFR-Inhibitoren bei Menschen mit Mutationen in einem Gen namens EGFR nicht immer Tumore schrumpfen ließ. Biologen wussten, dass EGFR-Mutationen ein aggressives Tumorwachstum begünstigen, insbesondere wenn das Gen amplifiziert ist. EGFR-Amplifikationen treten häufig bei Glioblastomen auf, aber die Hemmstoffe helfen Menschen mit diesen Hirntumoren oft nur wenig. „Und das war beunruhigend“, sagt Mischel.
Mischel machte sich auf die Suche nach einer Erklärung für dieses Paradoxon und stellte 2010 etwas Seltsames fest: Die Tumore waren eine Mischung aus Zellen, von denen einige viel EGFR-Gen enthielten und andere nur sehr wenig. Also beschloss er, diese beiden Zelltypen in ihren eigenen Petrischalen wachsen zu lassen, um zu sehen, was passieren würde.
Es schien fast wie ein dummes Experiment.
„Alles, was wir über klassische Genetik wissen, besagt, dass Mutterzellen Tochterzellen hervorbringen sollten, die ihnen genetisch ähnlich sind“, erklärt Mischel. Stattdessen bildeten die beiden unterschiedlichen Mutterzellen Tumore, die gleich aussahen: beide hatten einige Zellen mit viel EGFR, einige mit wenig und einige dazwischen. „Und das machte nach der klassischen Genetik keinen Sinn.“
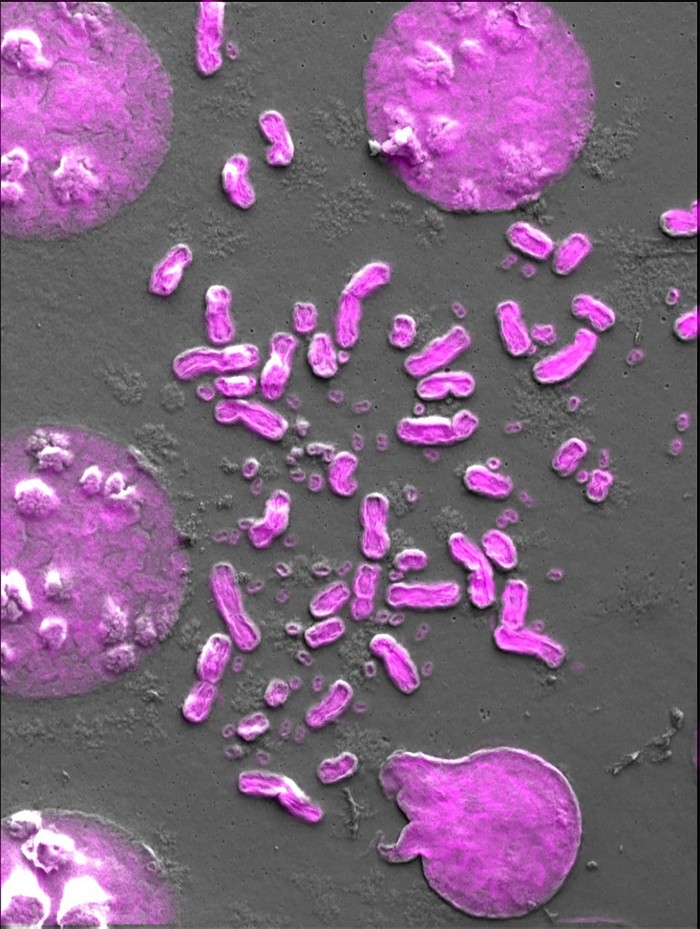
Also kehrte Mischel zur altmodischen Mikroskopie zurück, um zu sehen, was in diesen Zellen vor sich ging. Wenn sich unsere Zellen zur Teilung bereit machen, ist unser Genom fein säuberlich in unsere 23 Chromosomenpaare verpackt, die sich aneinanderreihen, bevor sie sorgfältig auf zwei Tochterzellen verteilt werden. In diesem Moment haben Wissenschaftler die Möglichkeit, die Chromosomen unter dem Mikroskop zu untersuchen und festzustellen, ob etwas nicht in Ordnung ist. Indem er das EGFR-Gen rot und die Chromosomen blau färbte, entdeckte Mischel, dass die Zellen mit dem übersät waren, was er ecDNA nannte – rote Punkte. Als die Zellen mit einem EGFR-Inhibitor behandelt wurden, verschwanden die roten Punkte. Wurde das Medikament entfernt, kamen die roten Punkte wieder zum Vorschein.
Die Studie wurde 2013 in Science veröffentlicht und löste „ein kolossales Kopfkratzen“ aus, sagt Mischel. „Die Leute wussten nicht so recht, was sie davon halten sollten“.
Mischel stieß bald auf ein einzigartiges Merkmal, das half, die Seltsamkeit der ecDNA zu erklären. Den Kreisen fehlten die Zentromere, die normalerweise in der Mitte jedes Chromosoms zu finden sind und für die gleichmäßige Aufteilung der DNA auf die Tochterzellen unerlässlich sind. Ohne Zentromere hat eine Zelle keine Möglichkeit, die zirkuläre DNA gleichmäßig unter ihren Nachkommen aufzuteilen, und die Kreise werden willkürlich verteilt. Es kann leicht passieren, dass eine Zelle mehr Kreise hat als die andere, und wenn der Tumor wächst, wird er zu einem Flickenteppich von Zellen – einige mit viel ecDNA, andere mit sehr wenig, und einige dazwischen.
Diese ungleiche Verteilung half Mischel auch zu verstehen, warum die Glioblastom-Tumoren, die mit EGFR-Inhibitoren behandelt werden, sich so schnell erholen. Zellen mit vielen DNA-Kreisen wurden von dem Medikament hart getroffen; offenbar waren sie von ihren EGFR-Amplifikationen abhängig geworden. Die Zellen mit nur geringen Reserven an ecDNA überlebten den Beschuss durch das Medikament, und sobald das Medikament entfernt wurde, bildeten sie schnell weitere Kreise, was das erneute Wachstum des Tumors vorantrieb. Wieder einmal war der Tumor ein Sammelsurium von Zellen mit wenig bis viel ecDNA.
Aus der Sicht einer einzelnen Zelle stellt die ecDNA einen Kompromiss zwischen Stärke und Schwäche dar. Aber für den Tumor als Ganzes ist es das Beste aus beiden Welten: die Vorteile des aggressiven Wachstums von Zellen, die bis zum Rand mit DNA-Zirkeln vollgestopft sind, plus das Sicherheitsnetz von Zellen, die mit kaum etwas von dem Zeug auskommen können. „Das ist ein ziemlich gutes Geschäft für einen Tumor“, sagt Mischel.
Und eine ziemlich schreckliche Sache für Menschen mit Krebs.

Lösungen für die Sequenzierung
Ein Grund dafür, dass zirkuläre DNA so lange im Verborgenen blieb, ist, dass die Wissenschaftler einfach keine guten Werkzeuge hatten, um sie zu finden. Die Gensequenzierung war früher umständlicher, und unsere Algorithmen zur Interpretation von Genomdaten waren nicht darauf trainiert, diese zirkulären Leckerbissen aufzuspüren.
Bei den meisten Sequenzierungstechnologien werden mehrere Kopien des Krebsgenoms angefertigt und in kurze Stücke zerlegt, die von Sequenziermaschinen leicht gelesen werden können. Dann gleicht ein Algorithmus diese DNA-Abschnitte mit einem Referenzgenom eines gesunden Menschen ab.
Dieser Prozess funktioniert gut genug für die lineare DNA auf den Chromosomen. Bei der zirkulären DNA ist das anders.
Ein Sequenzer könnte zum Beispiel das hypothetische Gen ABCDE in ABC und DE zerlegen. Wenn ABCDE jedoch auf einem Kreis liegt, berührt der Anfang des Gens (A) das Ende des Gens (E). Daraus ergibt sich ein Problem: Der Kreis könnte so zerschnitten werden, dass Teile – wie EA – entstehen, die im Referenzgenom nicht vorkommen; der Algorithmus würde diese als Fehler betrachten und sie verwerfen.
Dieses Manko bedeutet, dass uns seit fast 20 Jahren Hinweise auf die Häufigkeit von ecDNA fehlen.
Obwohl Mischels Studien darauf hinwiesen, dass ecDNA beim Glioblastom eine Rolle spielt, konnte er nicht einfach herausfinden, ob das Phänomen auch bei anderen Krebsarten auftritt.
Ein paar neue Instrumente haben ihm und anderen geholfen, diese Frage zu beantworten.
Vineet Bafna, ein Computerwissenschaftler an der UCSD, der am Humangenomprojekt mitgearbeitet hat, entwickelte zusammen mit Mischel eine Software zur Erkennung und Quantifizierung von ecDNA in Mikroskopbildern von Krebszellen. Bafnas Gruppe hat auch ein Programm geschrieben, mit dem sequenzierte Krebsgenome nach Hinweisen auf das Vorhandensein zirkulärer DNA durchsucht werden können; ein drittes Programm von ihm hilft, die Gene auf der ecDNA in der richtigen Reihenfolge anzuordnen.
Ein weiteres wichtiges Instrument stammt von Birgitte Regenberg, einer Biologin an der Universität Kopenhagen, die 2010 zirkuläre DNA in Hefe entdeckte. Ihr Labor entwickelte Circle-Seq, eine Methode zur physischen Isolierung von ecDNA aus Zellen, zur Entfernung aller verbleibenden linearen DNA mit Enzymen und zur Sequenzierung der verbleibenden zirkulären DNA.
Die Gruppen haben mit ihren Instrumenten gezeigt, dass zirkuläre DNA viel häufiger vorkommt, als ihre ersten Studien vermuten ließen. Im Jahr 2015 entdeckte Regenberg mit Circle-Seq mehr als 1.700 einzigartige DNA-Kreise in Hefe, die etwa 23 % des Genoms ausmachen. Und 2017 untersuchten Mischel und Bafna mit ihrer Bildanalyse- und Sequenzierungssoftware 2 500 Krebszellen und fanden ecDNA in 40 % der Tumorzelllinien.
„Zirkuläre DNA taucht immer dann auf, wenn wir Resistenzen feststellen.“
-Jonathan Houseley, Genetiker, Babraham-Institut
Die Studien von Mischel und Bafna lieferten eine Antwort auf ein langjähriges Rätsel, wie Krebszellen ihre Gene so schnell vermehren können. „Wir haben viele fruchtlose Tage damit verbracht, die einfachste und klarste Erklärung für Veränderungen in der Kopienzahl zu finden“, sagt Bafna. Die alten Sequenzierungstechniken sagten den Wissenschaftlern, dass Genamplifikationen wahrscheinlich auf Chromosomen zu finden sind. Die Forschungsergebnisse von Bafna und Mischel legen nahe, dass ecDNA wahrscheinlich die vorherrschende Art und Weise ist, in der viele Krebsarten Gene amplifizieren. Diese Entdeckung, sagt Bafna, war eine „Offenbarung“.
Einige Wissenschaftler, darunter auch Regenberg, finden DNA-Kreise in scheinbar normalen Zellen, obwohl ihre Bedeutung sehr umstritten ist. Diese Kreise sind oft zu klein, um ein komplettes Gen zu enthalten, während die ecDNA in Krebszellen groß genug ist, um mehrere Gene zu tragen, die mit dem Tumorwachstum verbunden sind.
Es gibt sogar immer mehr Hinweise darauf, dass viele Organismen DNA-Kreise als allgemeine Strategie nutzen, um sich gegen Dinge zu wappnen, die sie normalerweise töten sollten. Hefe, der Protozoen-Parasit Leishmania und Unkraut verwenden alle DNA-Kreise, um sich gegen giftige Moleküle, Medikamente und Herbizide zu wehren, stellt Jonathan Houseley fest, ein Genetiker des Babraham-Instituts, der ecDNA in Hefe untersucht. „Zirkuläre DNA taucht immer dann auf, wenn wir eine Resistenz beobachten.
Zirkuläre DNA im Kontext
Zirkuläre DNA bietet eine saubere Erklärung dafür, wie Tumorzellen so schnell Genamplifikationen und Arzneimittelresistenz erwerben können. Doch jedes Mal, wenn Forscher versuchen, den Mechanismus zu enträtseln, durch den ecDNA entsteht und funktioniert, wird die Geschichte noch seltsamer.
Die Forscher, die 1965 die Doppelminuten entdeckten, sahen sie beim Neuroblastom, einem seltenen Nervensystemtumor bei Kindern. Später stellten die Wissenschaftler fest, dass diese DNA-Kreise manchmal Amplifikationen eines krebsfördernden Gens namens MYCN tragen. Diese MYCN-Amplifikationen sind eine schlechte Nachricht für Menschen mit Krebs. Und frustrierenderweise hat ein Teil der Menschen mit diesen Amplifikationen besonders aggressive Tumore. Bis vor kurzem konnten die Ärzte nicht erklären, warum.
Es hat sich herausgestellt, dass DNA-Kreise nicht gerne an einem Ort bleiben. Anton Henssen, ein pädiatrischer Onkologe am Max-Delbrück-Centrum für Molekulare Medizin, und Richard Koche vom Memorial Sloan Kettering Cancer Center haben ecDNA in Neuroblastom-Tumoren unter die Lupe genommen und festgestellt, dass die zirkuläreDNA manchmal in Chromosomen zurückrutschen kann. Auf diese Weise kann sie neue Mutationen einführen und andere Gene stören. Henssen und Koche analysierten Daten von Neuroblastom-Patientenproben und fanden heraus, dass Menschen mit ecDNA geringere Überlebenschancen hatten, und dass die Chancen für diejenigen mit DNA-Kreisen, die sich wieder in die Chromosomen integriert hatten, noch schlechter waren.
Mischel und Bafna entdeckten ein ähnliches Phänomen beim Glioblastom. Wenn man einen EGFR-Inhibitor verabreicht, springt die zirkuläre DNA zurück in die Chromosomen. Dies deutet darauf hin, dass manchmal Genvermehrungen auf Chromosomen und Genvermehrungen in Kreisen eng miteinander verbunden sind. Wenn das Medikament entfernt wurde, spuckten die Chromosomen die DNA-Kreise wieder aus, und manchmal brachten die Kreise ein neues Gen mit sich.
Die Eigenheiten der ecDNA sind damit noch nicht erschöpft. Wir wissen jetzt, dass ecDNA nicht nur eine nackte DNA-Doppelhelix ist. Unsere Zellen organisieren die DNA, indem sie sie um Proteine namens Histone wickeln. Wenn die Umhüllung straff gehalten wird, werden die Gene ausgeschaltet, und wenn die DNA von den Histonen gelöst wird, werden die Gene eingeschaltet. Mischel, Bafna, Roel Verhaak vom Jackson Laboratory und der Genetiker Howard Chang von der Stanford University entdeckten, dass DNA-Kreise größtenteils nicht aufgerollt sind.
„Ich wette, dass ein einziges vielversprechendes Medikament eine Revolution auslösen wird.
-Geoffrey Wahl, Krebsbiologe, Salk Institute for Biological Studies
Das erklärte eine weitere Erkenntnis des Teams: Die Gene auf den DNA-Kreisen gehörten zu den am stärksten transkribierten im Krebsgenom. Die Krebszellen nutzten die ecDNA, um enorme Mengen an RNA zu produzieren, die wiederum zur Herstellung von Proteinen verwendet wurde, die das Wachstum des Tumors ankurbelten.
Diese Entdeckungen erklärten jedoch nicht vollständig, warum die Genexpression so hoch war. Es stellte sich heraus, dass DNA-Kreise Teile des genetischen Codes enthalten, die Enhancer genannt werden und die wie Lautsprecher für die Genexpression wirken. Normalerweise ist ein Enhancer für ein Gen weit von dem Enhancer für ein anderes Gen entfernt, aber durch die kreisförmige Form der ecDNA liegen alle Enhancer und Gene dicht beieinander. „Es gibt eine komplette Neuverdrahtung der Enhancer-Gene-Interaktionen“, sagt Peter Scacheri von der Case Western Reserve University, der diese Neuverdrahtung zusammen mit Jeremy Rich von der UCSD entdeckt hat.
Mischels Team sowie die Gruppe von Henssen und Koche berichteten über ähnliche Ergebnisse zu Enhancern. „Dies ist einer dieser magischen Momente in der Wissenschaft, in denen mindestens drei unabhängige Gruppen auf dasselbe Konzept kommen“, sagt Scacheri.
Koche und Henssen sagen, dass diese Entdeckungen längst überfällig waren. Bei der erneuten Sequenzierung von Neuroblastom-Tumoren stellten sie außerdem fest, dass zirkuläre DNA nun Anomalien in Daten erklären kann, die in früheren Experimenten verworfen worden waren. „Wir werden noch viel mehr entdecken können, wenn wir frühere Datensätze unter Berücksichtigung zirkulärer DNA auswerten“, sagt Koche. „Ich denke, dass dies eine sehr ergiebige Quelle sein wird, die derzeit noch ungenutzt ist.“
Auf der Suche nach einem Ziel
Auf einem Investorentreffen präsentierte Zachary Hornby, CEO von Boundless Bio, kürzlich die Ergebnisse eines unveröffentlichten Experiments. Die Wissenschaftler des Unternehmens behandelten eine Schale mit Krebszellen mit einem Medikament, das gegen ein Gen auf der ecDNA gerichtet ist. Obwohl die Kreise, die dieses Gen trugen, zurückgingen, bildeten sich an ihrer Stelle bald Kreise mit einem anderen tumorfördernden Gen. Der Versuch, die Gene auf diesen Kreisen zu blockieren, war wie ein Spiel mit dem Maulwurf. „Das hat große Auswirkungen“, sagte Hornby. „Es bedeutet im Grunde, dass ein gezielter therapeutischer Ansatz bei dieser Art von Patienten nicht wirksam sein wird.“
In den letzten zwei Jahrzehnten haben Arzneimittelentwickler einen Großteil der Zeit damit verbracht, Wirkstoffe zu entwickeln, die selektiv auf Proteine von Genen abzielen, die mit Krebs in Verbindung stehen. Doch wie Mischels Glioblastom-Forschung zeigte, funktioniert dieser Ansatz der Präzisionsonkologie nicht immer, insbesondere wenn man versucht, Proteine zu blockieren, die von Genen auf DNA-Kreisen gebildet werden. Es könnte noch schwieriger sein, herauszufinden, was mit ecDNA zu tun ist, als sie zu untersuchen.
Da wir immer noch nicht wissen, wie die Bildung oder Reintegration von ecDNA gesteuert wird, ist Henssen der Meinung, dass die beste Strategie für Arzneimittelentwickler darin bestehen könnte, ecDNA-abhängige Zellen indirekt anzugreifen. „Die bloße Anwesenheit von ecDNA könnte dazu führen, dass sich die Zellen anders verhalten als eine Zelle, in der diese Kreise nicht herumschwirren. Und dieses andere Verhalten könnte die Zelle für bestimmte Therapien anfällig machen, die dem normalen Gewebe nicht schaden würden“, sagt er. „Ich bin ziemlich zuversichtlich, dass es Mechanismen gibt, die gefunden werden können.
Boundless hat sich der Entdeckung dieser Mechanismen verschrieben. Hornby betrachtet auch nicht die ecDNA selbst oder die krebsfördernden Gene, die sie trägt, als Ziel des Medikaments. „Wir versuchen nicht, ecDNA direkt zu binden“, sagt er. „Vielmehr versuchen wir, die unterstützende Maschinerie zu hemmen, auf die sich die ecDNA stützt. Das Team hat es auf drei Schwachstellen abgesehen: die enzymatische molekulare Maschinerie, die die Replikation und Transkription der ecDNA unterstützt, die metabolischen Codependenzen, d. h. die Stoffwechselwege, auf die ecDNA-beladene Zellen angewiesen sind, um zu überleben und zu gedeihen, und die DNA-Schadensbeseitigungswege.
„In jeder Kategorie gibt es Schlüsselproteine, die wir gerade validieren, oder in einigen Fällen glauben wir, dass wir Ziele validiert haben“, sagt Hornby.
Der Gedanke, dass ecDNA neue Strategien für die Behandlung von Krebs hervorbringen könnte, findet allmählich mehr Beachtung. Henssen, Koche und Scacheri sagen, dass sie von Risikokapitalgebern und Pharmaunternehmen angesprochen wurden, die sich für ecDNA interessieren, obwohl noch keiner von ihnen ein Unternehmen gegründet hat.
„Ich wette mit Ihnen, dass ein einziges vielversprechendes Medikament eine Revolution auslösen wird. Aber es gibt eine Menge Herausforderungen“, sagt Wahl von Salk.
„Ich glaube, das Feld wird explodieren“, sagt Mischel. „Das ist eine Biologie, die man nicht ignorieren kann.“

